Юперио в Вологде
Инструкция по применению Юперио
Действующее вещество
Валсартан+СакубитрилПоказания
Хроническая сердечная недостаточность (II-IV класса по классификации NYHA) у пациентов с систолической дисфункцией с целью снижения риска сердечно-сосудистой смертности и госпитализации по поводу сердечной недостаточности.
Противопоказания
- Повышенная чувствительность к сакубитрилу или к валсартану, а также к другим вспомогательным компонентам препарата.
- Одновременное применение с ингибиторами ангиотензинпревращающего фермента (АПФ), а также период 36 часов после отмены ингибиторов АПФ.
- Наличие ангионевротического отека в анамнезе на фоне предшествующей терапии ингибиторами АПФ или АРА II.
- Одновременное применение с алискиреном у пациентов с сахарным диабетом или у пациентов с умеренным или тяжелым нарушением функции почек (рСКФ
- Нарушение функции печени тяжелой степени (класс С по классификации Чайлд Пью), биллиарный цирроз и холестаз.
- Препарат Интресто не рекомендуется для применения у детей в возрасте до 18 лет в связи с отсутствием данных по эффективности и безопасности.
- Беременность, планирование беременности и период грудного вскармливания.
- Одновременное применение с другими препаратами, содержащими АРА II, т.к. в состав препарата входит валсартан.
С осторожностью
Следует соблюдать осорожность при применении препарата Юперио у пациентов с тяжелыми нарушениями функции почек (рСКФ
Следует соблюдать осторожность при одновременном применении препарата со статинами, ингибиторами фосфодиэстеразы 5-го типа.
Следует соблюдать осторожность при применении препарата у пациентов с ангионевротическим отеком в анамнезе в связи с отсутствием данных по применению препарата у пациентов данной категории. Пациенты негроидной расы могут быть более подвержены риску ангионевротического отека.
Состав
1 таблетка,покрытая пленочной оболочкой, 50 мг (25,7 мг + 24,3 мг) содержит:
Действующеевещество: сакубитрилаи валсартана гидратный комплекс натриевых солей — 56,551 мг (впересчете на кислотную форму безводную 50 мг, что эквивалентно содержаниюсакубитрила 24,3 мг и валсартана 25,7 мг);
Вспомогательныевещества:целлюлоза микрокристаллическая, гипролоза, кросповидон, магния стеарат, тальк,кремния диоксид коллоидный; оболочка: премикс оболочки белый(гипромеллоза, титана диоксид (E171), макрогол 4000, тальк), премиксоболочки красный (гипромеллоза, краситель железа оксид красный (E172), макрогол4000, тальк), премикс оболочки черный (гипромеллоза, краситель железа оксидчерный (E172), макрогол 4000,тальк).
1 таблетка,покрытая пленочной оболочкой, 100 мг (51,4 мг + 48,6 мг) содержит:
Действующеевещество:сакубитрила и валсартана гидратный комплекс натриевых солей — 113,103 мг(в пересчете на кислотную форму безводную 100 мг, что эквивалентно содержаниюсакубитрила 48,6 мг и валсартана 51,4 мг);
Вспомогательныевещества:целлюлоза микрокристаллическая, гипролоза, кросповидон, магния стеарат, тальк,кремния диоксид коллоидный; оболочка: премикс оболочки белый(гипромеллоза, титана диоксид (Е171), макрогол 4000, тальк), премикс оболочкижелтый (гипромеллоза, краситель железа оксид желтый (Е172), макрогол 4000,тальк), премикс оболочки красный (гипромеллоза, краситель железа оксид красный(Е172), макрогол 4000, тальк).
1 таблетка,покрытая пленочной оболочкой, 200 мг (102,8 мг + 97,2 мг) содержит:
Действующеевещество: сакубитрилаи валсартана гидратный комплекс натриевых солей — 226,206 мг(в пересчете на кислотную форму безводную 200 мг, что эквивалентно содержаниюсакубитрила 97,2 мг и валсартана 102,8 мг;
Вспомогательныевещества:целлюлоза микрокристаллическая, гипролоза, кросповидон, магния стеарат, тальк,кремния диоксид коллоидный; оболочка: премикс оболочки белый(гипромеллоза, титана диоксид (E171), макрогол 4000, тальк), премикс оболочкикрасный (гипромеллоза, краситель железа оксид красный (E172), макрогол4000, тальк), премикс оболочки черный (гипромеллоза, краситель железа оксидчерный (E172),макрогол 4000, тальк).
Описание
Таблетки 50 мг (25,7 мг + 24,3 мг)
Овальные двояковыпуклые таблетки, покрытые пленочной оболочкой белого с фиолетовым оттенком цвета с фаской, без риски. На одной стороне нанесена гравировка «LZ», на другой -«NVR». На поперечном разрезе ядро белого или почти белого цвета.
Таблетки 100мг (51,4мг + 48,6мг)
Овальные двояковыпуклые таблетки, покрытые пленочной оболочкой бледно-желтого цвета с фаской, без риски. На одной стороне нанесена гравировка «L1», на другой - «NVR». На поперечном разрезе ядро белого или почти белого цвета.
Таблетки 200 мг (102,8 мг + 97,2 мг)
Овальные двояковыпуклые таблетки, покрытые пленочной оболочкой светло-розового цвета с фаской, без риски. На одной стороне нанесена гравировка «L11», на другой - «NVR». На поперечном разрезе ядро белого или почти белого цвета.
Описание лекарственной формы
Таблетки 50 мг(25,7 мг + 24,3 мг)
Овальныедвояковыпуклые таблетки, покрытые пленочной оболочкой белого с фиолетовымоттенком цвета с фаской, без риски. На одной стороне нанесена гравировка «LZ»,на другой — «NVR».
Таблетки 100 мг(51,4 мг + 48,6 мг)
Овальныедвояковыпуклые таблетки, покрытые пленочной оболочкой светло-желтого цвета сфаской, без риски. На одной стороне нанесена гравировка «L1», на другой —«NVR».
Таблетки 200 мг(102,8 мг + 97,2 мг)
Овальныедвояковыпуклые таблетки, покрытые пленочной оболочкой светло-розового цвета сфаской, без риски. На одной стороне нанесена гравировка «L11», на другой —«NVR».
Фармакокинетика
Всасывание
После приемавнутрь комплекс сакубитрила и валсартана распадается на сакубитрил, которыйзатем метаболизируется с образованием метаболита — сакубитрилата, и валсартан;концентрации названных веществ в плазме крови достигают максимума через 0,5 ч,2 ч и 1,5 ч соответственно. Абсолютная биодоступность сакубитрила и валсартанапосле приема внутрь составляет ≥60% и 23% соответственно. Валсартан всоставе препарата Юперио обладает большей биодоступностью по сравнению сдругими таблетированными формами. В случае приема комплекса сакубитрила ивалсартана дважды в сутки равновесные концентрации сакубитрила, сакубитрилата ивалсартана достигаются через 3 дня. Статистически значимого накоплениясакубитрила и валсартана в равновесном состоянии не отмечается; в то же времянакопление сакубитрилата превышает концентрацию при однократном применении в1,6 раза. Прием комплекса сакубитрила и валсартана одновременно с приемом пищине оказывал клинически значимого влияния на показатели системного воздействиясакубитрила, сакубитрилата и валсартана. Снижение экспозиции валсартана вслучае приема комплекса сакубитрила и валсартана одновременно с приемом пищи несопровождается клинически значимым снижением терапевтического эффекта. Времяприема комплекса сакубитрила и валсартана не зависит от времени приема пищи.
Распределение
Комплекссакубитрила и валсартана в значительной степени связан с белками плазмы крови(94%–97%). Сравнение экспозиций в плазме крови и СМЖ показывает, чтосакубитрилат в небольшой степени проникает через гематоэнцефалический барьер(0,28%). Кажущийся объем распределения комплекса составляет от 75 до 103 л.
Метаболизм
Сакубитрил поддействием ферментов быстро превращается в сакубитрилат, который далеесущественно не метаболизируется. Валсартан метаболизируется в незначительнойстепени, в виде метаболитов обнаруживается лишь около 20% от введенной дозы. Вплазме крови в незначительных концентрациях (<10%) обнаруживалсягидроксильный метаболит. Поскольку и сакубитрил, и валсартан в минимальнойстепени метаболизируются при участии изоферментов цитохрома CYP450, изменениеих фармакокинетики в случае одновременного применения препаратов, влияющих наизоферменты CYP450, представляется маловероятным.
Выведение
После приемавнутрь 52–68% сакубитрила (главным образом, в виде сакубитрилата) и ~13%валсартана и его метаболитов выводятся почками; 37–48% сакубитрила (главнымобразом в виде сакубитрилата) и 86% валсартана и его метаболитов выводятсячерез кишечник.
Сакубитрил,сакубитрилат и валсартан выводятся из плазмы крови со средними периодамиполувыведения (T1/2), составляющими приблизительно1,43 ч, 11,48 ч и 9,90 ч соответственно.
Линейность/нелинейность
В изученномдиапазоне доз комплекса сакубитрила и валсартана (50–400 мг)фармакокинетические параметры сакубитрила, сакубитрилата и валсартанаизменяются пропорционально дозе.
Фармакокинетикав особых клинических случаях
Пациенты старше65 лет
Экспозициисакубитрилата и валсартана у пациентов данной категории выше на 42% и 30%соответственно, чем у пациентов более молодого возраста. Подобные различия несвязаны с клинически значимыми эффектами, поэтому коррекции дозы препарата нетребуется.
Пациенты моложе18 лет
Применениепрепарата у пациентов данной категории не изучено.
Пациенты снарушениями функции почек
Длясакубитрилата наблюдалась корреляция между функцией почек и площадью под кривой«концентрация-время» (AUC), для валсартана такой корреляции не наблюдалось. У пациентовс нарушениями функции почек легкой (расчетная скорость клубочковой фильтрации(рСКФ) 89–60 мл/мин/1,73 м2) и умеренной степени тяжести (59–30мл/мин/1,73 м2).
AUCсакубитрилата была в 2 раза выше, чем у пациентов с нормальной функцией почек.У пациентов с нарушениями функции почек легкой и умеренной степени тяжестикоррекции дозы препарата не требуется.
У пациентов снарушениями функции почек тяжелой степени (рСКФ <30 мл/мин/1,73 м2)AUC сакубитрилата увеличивалась в 2,7 раза, у пациентов данной категориирекомендуемая начальная доза препарата составляет 50 мг 2 раза в сутки. Следуетсоблюдать осторожность при применении препарата у пациентов с нарушениемфункции почек тяжелой степени в связи с ограниченностью соответствующих данных.
Данных поприменению препарата у пациентов, находящихся на гемодиализе, нет. Однако исакубитрилат, и валсартан в значительной степени связываются с белками плазмыкрови, поэтому их эффективное удаление из крови при гемодиализе маловероятно.
Пациенты снарушениями функции печени
У пациентов снарушениями функции печени легкой и умеренной степени тяжести экспозициясакубитрила увеличивалась в 1,5 и 3,4 раза соответственно. Экспозициясакубитрилата — в 1,5 и 1,9 раза, валсартана — в 1,2 и 2,1 раза (всравнении со здоровыми добровольцами). У пациентов с нарушениями функции печенилегкой степени тяжести (класс А по классификации Чайлд-Пью), включая пациентовс обструкцией желчных путей, коррекции дозы препарата не требуется.
У пациентов снарушениями функции печени умеренной степени (класс В по классификацииЧайлд-Пью) рекомендуемая начальная доза препарата составляет 50 мг 2 разав сутки.
В связи сотсутствием данных применение у пациентов с нарушениями функции печени тяжелойстепени не рекомендовано.
Этническаяпринадлежность
Фармакокинетикакомплекса сакубитрила и валсартана (сакубитрил, сакубитрилат и валсартан)у пациентов разных расовых и этнических групп существенно не различается.
Пол
Фармакокинетикакомплекса сакубитрила и валсартана (сакубитрил, сакубитрилат и валсартан)у мужчин и женщин существенно не различается.
Фармакодинамика
Фармакодинамические эффекты сакубитрила и валсартана, входящих всостав препарата, оценивали после его однократного и многократногоприменения у здоровых добровольцев, а также у пациентов схронической сердечной недостаточностью. Отмечающиеся эффектысоответствовали механизму действия комплекса действующих веществ,состоящем в одновременном подавлении неприлизина и блокадеРААС.
В семидневном исследовании у пациентов со сниженной фракциейвыброса (ФВ) левого желудочка, в котором валсартан применяли вкачестве контроля, применение сакубитрила и валсартана приводило кстатистически значимому кратковременному увеличению натрийуреза,увеличению концентрации цГМФ в моче и снижению концентрациипредсердного натрииуретического пептида (MR-proANP) и N-концевогофрагмента предшественника мозгового натрииуретического пептида(NT-proBNP) в плазме крови (по сравнению с валсартаном).
В 21-дневном исследовании у пациентов со сниженной ФВ левогожелудочка применение сакубитрила и валсартана вызывалостатистически значимое увеличение концентрации предсердногонатрииуретического пептида (ANP) и цГМФ в моче и концентрации цГМФв плазме крови, а также снижение плазменных концентраций NT-proBNP,альдостерона и эндотелина-1 (по сравнению с исходным состоянием).Кроме того, применение сакубитрила и валсартана блокируетAT1-рецептор, на что указывает увеличение активности и концентрацииренина в плазме крови.
В другом исследовании комплекс сакубитрила и валсартана вызывалболее выраженное снижение концентрации NT-proBNP в плазме крови иболее значительное повышение концентраций мозговогонатрийуретического пептида (BNP) и цГМФ в моче, чем эналаприл. В товремя как BNP является субстратом неприлизина, NT-proBNP таковым неявляется, в связи с чем NT-proBNP, в отличие от BNP, можноиспользовать в качестве биомаркера при мониторинге пациентов ссердечной недостаточностью, получающих комплекс сакубитрила ивалсартана. В исследовании с подробным изучением интервала QTc уздоровых добровольцев мужского пола применение комплексасакубитрила и валсартана однократно в дозах 400 мг и 1200 мг неоказывало влияния на реполяризацию миокарда.
Неприлизин — один из нескольких ферментов, участвующих вметаболизме амилоида-р (Ар) головного мозга и спинномозговойжидкости (СМЖ). На фоне применения комплекса сакубитрила ивалсартана в дозе 400 мг 1 раз в сутки в течение 2 недель уздоровых добровольцев концентрация Ар 1-38 в СМЖ увеличивалась; приэтом концентрациbАР 1-40 и 1-42 в СМЖ не менялись. Клиническоезначение этого факта неизвестно. В клиническом исследованииприменение комплекса сакубитрила и валсартана у пациентов схронической сердечной недостаточностью статистически достоверноснижало риск летального исхода по причине сердечно-сосудистойпатологии или госпитализации в связи с острой сердечнойнедостаточностью (21,8% в группе исследуемого препарата против26,5% в группе эналаприла).
Абсолютное снижение риска летального исхода по причинесердечно-сосудистой патологии или госпитализации в связи с остройсердечной недостаточностью составляло 4,7%о (3,1%о для рискалетального исхода по причине сердечно-сосудистой патологии и 2,8%)для первичной госпитализации в связи с острой сердечнойнедостаточностью).
Относительное снижение риска по сравнению с эналаприломсоставляло 20%. Эффект отмечен на ранних этапах примененияпрепарата и сохранялся на протяжении всего периода исследования.Развитию эффекта способствовали оба действующих компонентапрепарата. Частота случаев внезапной смерти, которые составляли 45%всех летальных исходов по причине сердечно-сосудистой патологии, вгруппе исследуемого препарата снизилась на 20% по сравнению сгруппой эналаприла (отношение рисков (hazard rAT1o, HR) 0,80,р=0,0082).
Частота случаев развития недостаточности сократительной функциимиокарда, которая являлась причиной летального исхода в 26% случаевпо причине сердечно-сосудистой патологии, в группе исследуемогопрепарата снизилась на 21% по сравнению с таковым показателем вгруппе эналаприла (HR 0,79, р=0,0338).
Побочные действия
Выявленные нежелательные явления (НЯ) соответствовали фармакологическим характеристикам препарата Юперио и сопутствующим заболеваниям, имеющимся у пациентов. Наиболее часто встречавшимися НЯ были выраженное снижение артериального давления, гиперкалиемия и нарушение функции почек, вызванные коррекцией дозы препарата Юперио или прекращением терапии. Частота НЯ не зависела от пола, возраста или расовой принадлежности пациентов. НЯ перечислены в соответствии с системно-органным классом медицинского словаря для нормативно-правовой деятельности MedDRA. В пределах каждого системно-органного класса НЯ распределены по частоте возникновения в порядке уменьшения их важности.
Для оценки частоты использованы следующие критерии: очень часто (>1/10); часто (от >1/100 до 1/1,000 до 1/10000 до
Нарушения со стороны обмена веществ и питания: очень часто - гиперкалиемия; часто - гипокалиемия.
Нарушения со стороны нервной системы: часто - головокружение, головная боль; нечасто - ортостатическое головокружение.
Нарушения со стороны органа слуха и лабиринтные нарушения: часто — вертиго.
Нарушения со стороны сосудов: очень часто - выраженное снижение АД: часто - обморок, ортостатическая гипотензия.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: часто - кашель.
Нарушения со стороны желудочно-кишечного тракта: часто - диарея, тошнота.
Нарушения со стороны колеи и подкожных тканей: нечасто - ангионевротический отек.
Нарушения со стороны почек и мочевыводящих путей: очень часто - нарушение функции почек; часто - почечная недостаточность (в т.ч. острая почечная недостаточность).
Общие расстройства и нарушения в месте введения: часто - повышенная утомляемость, астения.
Если любые из указанных в инструкции побочных эффектов усугубляются, или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Взаимодействия
Противопоказанныелекарственные взаимодействия
Ингибиторы АПФ
Препарат Юпериопротивопоказан к применению одновременно с иАПФ, поскольку ингибированиенеприлизина одновременно с применением иАПФ может увеличивать риск развитияангионевротического отека. Применение препарата Юперио возможно не раньше, чемчерез 36 часов после отмены иАПФ. Применение иАПФ возможно не раньше, чем через36 часов после последнего приема препарата Юперио.
Алискирен
Противопоказаноодновременное применение препарата Юперио с алискирен-содержащими препаратами упациентов с сахарным диабетом или с нарушениями функции почек (рСКФ<60 мл/мин/1,73 м2) и не рекомендовано у других пациентов.
Нерекомендуемыелекарственные взаимодействия
Антагонистырецепторов ангиотензина
Поскольку одноиз действующих веществ препарата является АРА II, одновременное применение сдругим препаратом, содержащим АРА II, не рекомендуется.
Лекарственныевзаимодействия, которые необходимо учитывать
ИнгибиторыГМГ-КоА редуктазы (статины)
Данныеисследований показывают, что сакубитрил подавляет активность переносчиковОАТР1В1 и ОАТР1В3. Препарат Юперио может увеличивать системную экспозицию такихсубстратов ОАТР1В1 и ОАТР1В3, как статины. У пациентов, получавших препаратЮперио одновременно с аторвастатином, максимальная концентрация в плазме крови(Cmax) аторвастатина и его метаболитов увеличивалась до 2 раз, a AUC— до 1,3 раз. Следует соблюдать осторожность при одновременном применениистатинов с препаратом Юперио. Не отмечено клинически значимого лекарственноговзаимодействия при одновременном применении препарата Юперио с симвастатином.
Силденафил
У пациентов свыраженным повышением АД, получающих препарат Юперио (до достижения равновеснойконцентрации), однократное применение силденафила усиливало антигипертензивноедействие по сравнению с применением препарата Юперио в монотерапии. По этойпричине у пациентов, получающих Юперио, применять силденафил или другойингибитор фосфодиэстеразы 5‑го типа следует с осторожностью.
Предполагаемыелекарственные взаимодействия, которые необходимо учитывать
Калий
Одновременноеприменение калийсберегающих диуретиков (например, триамтерена и амилорида),антагонистов минералокортикоидов (например, спиронолактона и эплеренона),препаратов калия или калийсодержащих заменителей поваренной соли может вызыватьповышение содержания калия и концентрации креатинина в сыворотке крови. Упациентов, получающих препарат Юперио одновременно с этими препаратами,рекомендуется регулярно контролировать содержание калия в сыворотке крови.
Нестероидныепротивовоспалительные препараты (НПВП), включая избирательные ингибиторыциклооксигеназы-2 (ингибиторы ЦОГ-2)
Применениепрепарата Юперио одновременно с НПВП у пациентов в возрасте старше 65 лет,у пациентов с гиповолемией (включая пациентов, получающих диуретики) и упациентов с нарушениями функции почек может увеличивать риск ухудшения функциипочек. У пациентов, получающих препарат Юперио одновременно с НПВП, приприменении подобной схемы лечения и в случае ее изменения рекомендуетсяконтролировать функцию почек.
Препараты лития
Возможностьлекарственного взаимодействия между препаратом Юперио и препаратами литияне изучали. При одновременном применении препаратов лития с иАПФ иАРА II отмечалось обратимое повышение содержание лития в сыворотке крови иусиление, в связи с этим, токсических проявлений.
У пациентов,получающих препарат Юперио вместе с препаратами лития, рекомендуется тщательноконтролировать содержание лития в сыворотке крови. В случае дополнительногоприменения диуретического лекарственного препарата риск токсического действиялития может увеличиваться.
Белки-переносчики
Активныйметаболит сакубитрила (сакубитрилат) и валсартан являются субстратамибелков-переносчиков ОАТР1В1, ОАТР1В3 и ОАТ3; валсартан также являетсясубстратом белка-переносчика MRP2. У пациентов, получающих препарат Юпериоодновременно с ингибиторами ОАТР1В1, ОАТР1В3, ОАТ3 (например, рифампицином ициклоспорином) или MRP2 (например, ритонавиром) может увеличиваться системнаяэкспозиция сакубитрилата или валсартана соответственно. В начале и при завершенииодновременного применения препарата Юперио и данной группы препаратов требуетсясоблюдать осторожность.
Отсутствиезначимых лекарственных взаимодействий
В случаеприменения препарата Юперио в комбинации с фуросемидом, дигоксином, варфарином,гидрохлоротиазидом, амлодипином, метформином, омепразолом, карведилолом,нитроглицерином внутривенно (в/в) или комбинированным препаратомлевоноргестрела и этинилэстрадиола клинически значимых взаимодействий выявленоне было. Взаимодействий с атенололом, индометацином, глибенкламидом(глибуридом) или циметидином при одновременном применении с препаратом Юперионе ожидается.
Взаимодействия сизоферментами системы цитохрома Р450
Имеющиесяисследования демонстрируют, что вероятность лекарственных взаимодействий, опосредованныхизоферментами цитохрома CYP450, невелика, так как комплекс действующих веществв незначительной степени метаболизируется при участии изоферментов CYP450.Комплекс действующих веществ препарата Юперио не является ингибитором илииндуктором изоферментов CYP450.
Передозировки
Данных о передозировке препаратом Юперио у человека недостаточно. Однократное применение препарата в дозе 1200 мг и многократное в дозе 900 мг у здоровых добровольцев сопровождалось хорошей переносимостью.
Наиболее вероятным симптомом передозировки является выраженное снижение АД, обусловленное антигипертензивным действием действующих веществ. В этом случае рекомендовано симптоматическое лечение.
При случайной передозировке следует вызвать рвоту (если препарат был принят недавно) или провести промывание желудка. В случае возникновения выраженного снижения АД в качестве терапии необходимо внутривенное введение 0,9% раствора натрия хлорида, пациента следует уложить, приподняв ноги, на необходимый для терапии период времени, принять активные меры по поддержанию деятельности сердечно-сосудистой системы, включая регулярный контроль деятельности сердца и дыхательной системы, объема циркулирующей крови (ОЦК) и количества выделяемой мочи. Удаление действующих веществ при проведении гемодиализа маловероятно, поскольку значительная их часть связывается с белками плазмы крови.
Фармакологическое действие
Действие препарата Юперио опосредовано новым механизмом, а именно, одновременным подавлением активности неприлизина (нейтральной эндопептидазы (neutral endopeptidase, NEP)) веществом LBQ657 (активным метаболитом сакубитрила) и блокадой рецепторов к ангиотензину II 1-го типа (AT1) валсартаном, являющегося антагонистом рецепторов ангиотензина II (АРА II).
Взаимодополняющие благоприятные эффекты сакубитрила и валсартана на состояние сердечно-сосудистой системы и почек у пациентов с сердечной недостаточностью обусловлены увеличением количества пептидов, расщепляемых неприлизином (таких как натрийуретические пептиды (НП)), что опосредовано действием LBQ657, при этом одновременно происходит подавление валсартаном негативных эффектов ангиотензина II.
НП активируют мембраносвязанные рецепторы, сопряженные с гуанилилциклазой, что приводит к повышению концентрации циклического гуанозинмонофосфата (цГМФ), вызывающего симптомы вазодилатации, увеличение натрийуреза и диуреза, увеличение скорости клубочковой фильтрации и почечного кровотока, подавление высвобождения ренина и альдостерона, снижение симпатической активности, а также антигипертрофическое и антифибротическое действие.
Валсартан, избирательно блокируя AT1-рецептор, подавляет негативные эффекты ангиотензина II на сердечно-сосудистую систему и почки, а также блокирует ангиотензин II-зависимое высвобождение альдостерона. Это предотвращает стойкую активацию ренин-ангиотензин-альдостероновой системы (РААС), которая вызывает сужение сосудов, задержку натрия и воды почками, активацию роста и пролиферацию клеток, а также последующую перестройку сердечно-сосудистой системы, усугубляющей нарушения в ее функционировании.
Источники
1. Государственный реестр лекарственных средств;
2. Анатомо-терапевтическо-химическая классификация (ATX);
3. Международная классификация болезней 10-го пересмотра;
4. Официальная инструкция производителя
Характеристики

Сертификаты Юперио
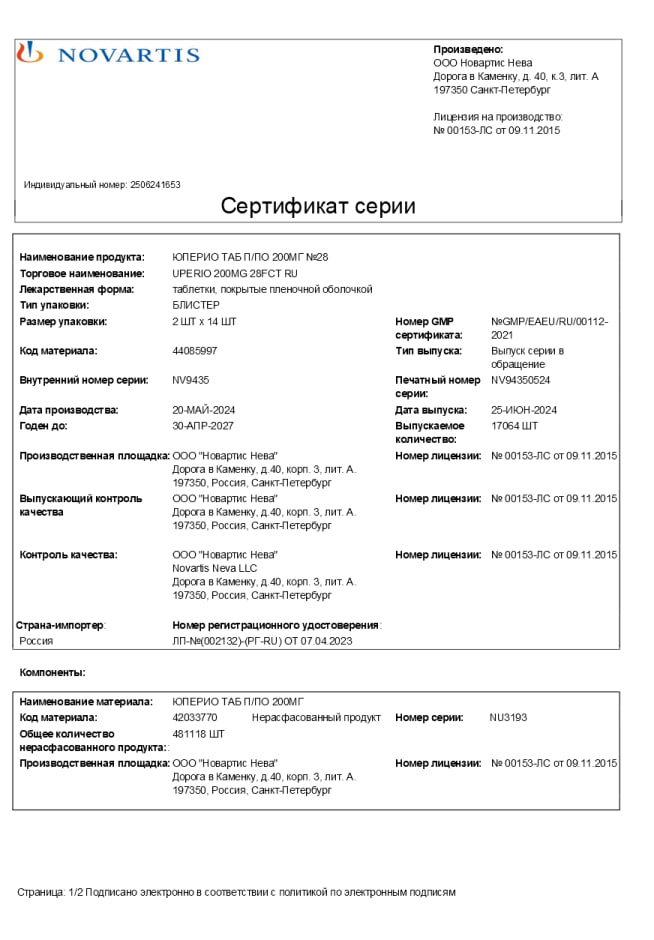
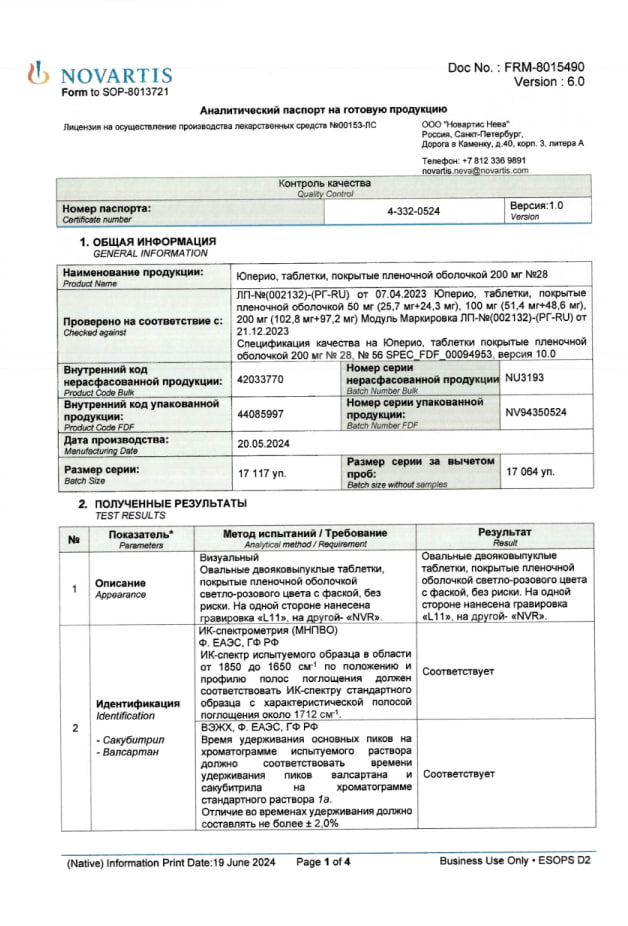



Фото Юперио